Жесткость воды. Соли жесткости
Жесткость воды — это совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»).
Соли жесткости имеют разные свойства. Так, при нагреве воды, некоторые из них выпадают в осадок в виде накипи, а некоторые — не выпадают. По этому признаку их и начали разделять.
Соли, выпадающие в осадок, стали называть солями временной (или устранимой) жесткости, а соли, которые не выпадают в осадок при нагреве воды, солями постоянной жесткости.
Сульфаты, хлориды и нитраты магния и кальция, растворенные в воде, образуют постоянную (или некарбонатную) жесткость. Они выпадают в осадок исключительно при полном испарении воды.
Временная жесткость характеризуется присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
При кипячении воды гидрокарбонаты разлагаются, образуя очень плохо растворимый карбонат кальция, углекислый газ и воду:
Общая жесткость складывается из постоянной и временной.
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Жёсткость воды — происхождение
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов.
Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород.
Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%).
С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
Жесткость воды — единицы измерения
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж).
1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
За рубежом приняты другие единицы измерения жесткости воды, соотношение этих единиц представлено ниже:
1°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3 воды;
1°DH = 10 мг CaO в 1 дм3 воды;
1°Clark = 10 мг CaCO3 в 0,7 дм3 воды;
1°F = 10 мг CaCO3 в 1 дм3 воды;
1 ppm = 1 мг CaCO3 в 1 дм3 воды.
Численные значения жесткости измеренные в мг-экв/л, моль/м3, и °Ж, несмотря на различия в обозначении, равны между собой.
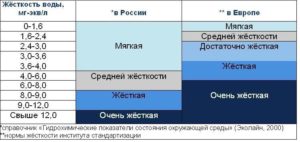
По значению общей жесткости природные воды делят на группы:
- очень мягкая вода (0–1,5 мг-экв/л)
- мягкая вода (1,5–4 мг-экв/л)
- вода средней жесткости (4–8 мг-экв/л)
- жесткая вода (8–12 мг-экв/л)
- очень жесткая вода (более 12 мг-экв/л).
Нормативные требования и рекомендации
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается.
Шкала жесткости воды
Выделяются следующие виды жесткости:
- Общая – определяется как суммарная концентрация ионов магния и кальция.
- Карбонатная – зависит от наличия в воде карбонатов, гидрокарбонатов кальция и магния. Практически полностью устраняется в ходе кипячения, поэтому второе название карбонатной жесткости – временная. В процессе нагрева гидрокарбонаты распадаются – образуется угольная кислота, а карбонаты кальция, гидроксиды магния выпадают в виде осадка.
- Некарбонатная – обусловлена присутствием магниевых и кальциевых кислотных солей. При кипячении не устраняется (то есть является постоянной).
Общая жесткость измеряется в GH. GH показывает суммарное содержание щелочноземельных металлов в виде ионов. Для примера – в воде, значение GH которой близкое к нулю, аквариумные рыбки не живут, употреблять ее в пищевых целях также не рекомендуется.
Рекомендации по устранению жесткости воды
Высокая жесткость воды ухудшает ее органолептические свойства, жесткая вода неблагоприятно действует на организм человека. Также из-за высокой жесткости образуется накипь. Отсюда возникает необходимость устранения жесткости.
Одним из методов снижения жесткости воды является ионный обмен, который реализуется на автоматических установках умягчения воды серии RFS.
Устранение жесткости воды при помощи установок умягчения реализовано по принципу замещения ионов кальция и магния в воде ионами натрия. Происходит процесс умягчения воды — ионообменный процесс, приводящий к снижению ее жесткости.
Удаление из воды солей жесткости происходит в фильтрующих колоннах. В процессе работы установки умягчения ионообменная емкость фильтрующего материала (катионита) уменьшается. Для восстановления обменной емкости катионита проводится регенерация. Регенерация осуществляется с использованием раствора соли (NaCl) и включает несколько стадий. Подробнее о работе установок снижения жесткости воды можно прочитать в разделе Каталог оборудования. Умягчение воды.
Существуют также установки умягчения воды непрерывного действия с использованием двух колонн, работающих поочередно. Они также подробно описаны на нашем сайте в рубрике Установки умягчения воды непрерывного действия.
Как повысить и понизить жесткость воды в аквариуме. Определение временной, или карбонатной жесткости
Чтобы создать комфортные условия для жизни аквариумных рыбок, важно использовать воду оптимальной жесткости, с заданным кислотно-щелочным балансом. Чтобы повысить жесткость воды, используют известняк и мрамор
Чем мягче вода, тем быстрее она повысит жесткость. Другой способ – химический, с применением хлористого кальция и магнезии
Чтобы повысить жесткость воды, используют известняк и мрамор. Чем мягче вода, тем быстрее она повысит жесткость. Другой способ – химический, с применением хлористого кальция и магнезии.
Максимальный эффект достигается при использовании обоих препаратов одновременно.
Чтобы уменьшить жесткость, воду нужно прокипятить. Как долго это следует делать? Учтите, что для снижения жесткости вдвое, кипятить воду нужно минимум в течение получаса. Другой способ – вымораживание. Воду наливают в пластиковый контейнер и помещают в морозилку. Затем лед растапливают, а полученную воду используются в пищевых или любых других целях.
Если объемы воды большие, проще будет использовать специальное оборудование. Широкое распространение в быту в последние годы получили установки обратного осмоса. Для расчета необходимого объема водопроводной воды используйте формулу – вычитание объема воды, получаемой из водопровода, из объема с заданной жесткостью, который нужно получить.
Часто методы умягчения используют комбинированно. Например, одну часть солей жесткости убирают реагентным способом, а другую с помощью катионного обмена. Приведем формулы содово-известкового способа умягчения:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
В итоге Mg(OH)2 коагулирует, выпадая в осадок. Затем, в целях устранения некарбонатной жесткости, вводится Na2CO3.
Последующие химические реакции:
В итоге образуется углекислый кальций, выпадающий затем в осадок. Реагенты вводят в разные зоны:
- хлор – во всасывающие трубопроводы;
- коагулянт – в трубопровод перед смесителем либо непосредственно в смеситель;
- известь – вместе с коагулянтом;
- уголь активированный – перед фильтрами;
- хлор и аммиак – в фильтрованную воду.
Опреснение, обессоливание, удаление растворенных газов, железа, стабилизация – это специальные способы очистки. Так если для снижения жесткости используются методы катионирования или ионного обмена, речь идет об обессоливании. Вода, которая получается на выходе, не содержит ни анионов, ни катионов солей.
Как измерить жесткость
Для оценки показателей жесткости воды используются следующие способы:
- Комплексонометрическое титрование трилоном Б. Метод сложный и самый точный.
- Покупные тесты. Не на 100% точные, зато простые и недорогие.
- Измерение электропроводности. Используйте кондуктометр.
- С помощью ионометра и ионоселективных электродов.
- С применением методики титрования соляной кислотой проб воды. Сложный и не очень точный метод. То же самое можно сказать о тестах с применение хозяйственного мыла.
Под титрованием подразумевается добавление в воду реагента требуемой концентрации. Концентрация солей жесткости определяется в зависимости от реакции реагента с водой. Приготовить реактив просто – достаточно смешать кислоту с дистиллированной водой в заданных пропорциях. Готовый раствор опасности не представляет.
Проще всего использовать готовые тексты. Для этого 5 мл воды наливается в стаканчик, затем в жидкость по каплям добавляется содержимое теста, после каждой капли вода перемешивается. Делать так нужно до тех пор, пока цвет не станет зеленым вместо розового.
Дополнительная информация
Интересные факты об очистке воды:
- Во многих странах существовала традиция бросать серебряные монеты в колодец. Серебро реагирует с солями, но не со всеми. Основная причина отказа от использования этого металла в очистке — токсичность. По нормам СанПиН серебру присвоен 2-й класс вредности, но оно опасно только при накоплении вещества в организме.
- Неочищенная вода была причиной многих эпидемий тифа, холеры и других заболеваний, а также низкой продолжительности жизни из-за увеличения количества вредных соединений в организме. Человечество пыталось создать очистительные сооружения начиная с древних времен. В Египте изобрели первые методы фильтрования.
- Существует миф, что нельзя кипятить воду несколько раз, потому что в ней образуются вредные вещества, но это не так. Состав раствора от повторного нагревания не изменяется.
- Многие считают, что бутилированная вода чище фильтрованной, но уровень содержания примесей у них одинаковый.
Подобрать подходящую систему очистки можно силами специалистов «КВАНТА +». Фильтры задерживают не все соединений, поэтому перед покупкой стоит узнать, какими солями насыщена вода.
Какой TDS нужен именно вашему аквариуму?
Составьте список жителей аквариума:
- растения
- рыбки
- креветки
- улитки
Посмотрите, какой параметр TDS оптимален для каждого из них (какой он у них в природе — возможно, поиск такой информации займёт немало времени) и выберите среднее значение. Возможно, от кого-то из выбранного населения придётся отказаться.
 TDS — это инструментально измеряемый параметр воды, поэтому с помощью электронного TDS-метра можно проводить измерения этого параметра в вашем аквариуме (да и, например, для измерения этого параметра в вашем водопроводе или после бытового фильтра, для человека вода с высоким TDS тоже вредна).
TDS — это инструментально измеряемый параметр воды, поэтому с помощью электронного TDS-метра можно проводить измерения этого параметра в вашем аквариуме (да и, например, для измерения этого параметра в вашем водопроводе или после бытового фильтра, для человека вода с высоким TDS тоже вредна).
Идеально, если вначале недели и в конце (перед подменой воды), в вашем аквариуме будет одинаковое значение этого параметра. Это будет означать, что удобрения потребляются в полном объёме, не накапливаются в аквариуме, а, значит, у водорослей есть лишь минимальные шансы для роста.
Если бы рыба не могла каким-то образом контролировать этот естественный поток, она бы либо быстро обезвоживалась, либо взрывалась. Но рыбы способны контролировать это посредством осморегуляции, сложной серии химических процессов.


Почки в основном работают над устранением избытка воды, но другой функцией является сохранение и реабсорбция незаменимых солей. Оба процесса работают для поддержания определенного баланса соли и воды.
Таким образом, высокое осмотическое давление (вызванное повышенным уровнем TDS за пределами естественного ареала рыбы) переполнит рыбу избытком воды и перегрузит почки, в то время как низкое осмотическое давление (вызванное уровнями TDS ниже уровней естественного ареала рыбы) лишит рыбу воды, вызвав обезвоживание.
 Почки рыб, которые встречаются в жесткой воде, не должны работать очень усердно. Рыбы с мягкой водой построены так, чтобы жить в воде, которую они быстро поглощают, чтобы вывести токсины.
Почки рыб, которые встречаются в жесткой воде, не должны работать очень усердно. Рыбы с мягкой водой построены так, чтобы жить в воде, которую они быстро поглощают, чтобы вывести токсины.
Маленькая тетра будет мочиться более чем в три раза больше своего веса каждый день.
Но чем выше TDS, тем труднее сделать это для рыб, поэтому токсины остаются в их организме дольше.
Влияют на их физиологию, вызывая стресс, и это неизбежно приведет к сокращению продолжительности жизни в зависимости от вида и разницы между TDS естественного ареала и TDS в аквариуме .
Отличия между жесткостью и мягкостью воды
Объем солевых примесей определяет количество находящихся в воде растворяемых веществ таких, как магний и кальций. Превысить норму примесей помогает попавший в гидрат железа, он в избытке содержится в водах, протекающий под землей.
Дождевую воду либо перегоняемую жидкость считают мягкой, в ней очень мало минеральных примесей. Также показатель мягкости можно повысить, прокипятив воду, либо добавив в нее специальные химические добавки.
Вода, имеющая среднюю жесткость, протекает в водопроводе, в родниках и скважинах.
Вода, отличается повышенной жесткостью в океанах и морях. Также жидкость, берущая начало в глубинных пластах породы, обогащенных минеральными веществами. В составе воды выделяют много разных солей, они могут достигать тридцати трех процентов общего количества жидкости.
Типы жесткости воды. Уровень жесткости в воде бывает:
1.постоянным, то есть показатель остается неизменным и зависит от количества в воде хлоридов и сульфатов.
2.временным, то есть на жесткость влияют присутствующие в воде бикарбонаты кальция с магнием. Показатель жесткости можно полностью понизить, если жидкость вскипятить.
3.общим, когда складывают постоянный и временный показатель.
Для определения уровня жесткости применяют специальные единицы измерения.
Единицы, измеряющие жесткость.
Перед тем, как посчитать жесткость воды, определяют в каком количестве в воде содержатся катионы магния и кальция.
Справка! Жесткость воды в России, выраженную молями, стали применять с 1952-го года. До этого общая жесткость определялась градусами, которые были равны единице измерения в Германии.
На территории России принята единица измерения в градусах, которая соответствует международным стандартам подсчета. Градус равняется 0.5 миллимоля на один литр воды. Сделать подсчет количества примесей в жидкости может каждый самостоятельно.
Влияние жесткости на качество воды
Избыток солей отрицательно действует и на здоровье людей, употребляющих жидкость, и на работу бытового оборудования. Негативное влияние солей выражается в следующем:
- попадая внутрь организма, агрессивные вещества наносят непоправимый ущерб здоровью. Нерастворимые компоненты постепенно копятся. Избыток солей способствует образованию камней в почках, закупорке сосудов;
- жесткий раствор негативно сказывается на внешнем виде. Кожа становится сухой, шелушится, появляется раздражение, на поверхности возникает угревая сыпь, прыщи;
- волосы часто ломаются, выглядят тусклыми и безжизненными, появляется перхоть. Жесткой жидкостью сложно промыть загрязнение волос, поэтому у корней они выглядят неопрятно;
- бытовые приборы чаще выходят из строя, забиваются внутренние детали и фильтры в стиральных машинках. Образуется накипь в чайниках, посудомоечных машинах, утюгах;
- повышенное содержание солей мешает пенообразованию, поэтому увеличивается расход моющих средств;
- жесткая вода ухудшает вкус напитков и блюд;
- находясь в системе отопления, соли накапливаются на стенках труб, ухудшая давление.
Что такое жёсткость воды и почему её нужно определять
На жёсткость воды влияет содержание в ней солей щёлочноземельных металлов, в частности кальция и магния. Положительно заряженные ионы этих минералов растворены в воде и влияют на её характеристики. Чем меньше солей содержится в воде, тем она мягче.
Различается два вида жёсткости: временная и постоянная. В первом случае проблема легко решается кипячением. Во втором придётся прибегать к очистным фильтрам.

Жёсткость воды обозначается градусами и мг-эквивалентами на 1 л.
1 мг-экв./л равен 20,04 мг кальция и 12,6 мг магния.
Допустимый предел жёсткости:
- в странах бывшего СССР — 7 мг-экв./л;
- В Европе — до 1,2 мг-экв./л.
По градусам жёсткости выделяется три категории воды:
Жёсткая — более 10°Ж.
- Средней жёсткости — от 2 до 10 °Ж.
- Мягкая — до 2 °Ж.
Интересно, что даже средняя жёсткость воды вызывает дискомфорт.
Почему нужно проверять жёсткость водопроводной воды? При регулярном употреблении человеком некачественного питья возникают такие проблемы, как камни в почках, печени и желчном пузыре. Определение жёсткости позволит скорректировать показатель до нормы и использовать ресурс без опасений.

Косвенным признаком жёсткости воды является не только известковый налёт на чайнике и посуде, но и некорректная работа приборов — посудомоечной, стиральной машины, кофемашины. При протечке крана появляются следы водного камня на сантехнике. Очищенная вода продлит срок службы бытовых приборов. Проверить жёсткость воды можно в лаборатории, а также домашними приёмами.
Как определить жесткость воды
Очень сложно определить на ощупь, какая вода — жесткая или мягкая. Термин «жёсткость» возник потому, что после стирки ткани теряют мягкость, шерстистость или шелковистость, становятся неприятно жесткими на ощупь. Ткацкие или трикотажные переплетения, независимо от плотности, имеют пористую структуру. К волокнам присоединяются соли, что делает вещи после стирки более грубыми, жесткими, плотными.
Определить жесткость воды в можно как в лаборатории, так и в домашних условиях. Наличие солей жесткости можно определить визуально:
- Напитки имеют неприятный горчащий вкус.
- Чаи завариваются дольше обычного.
- Мясо при варке становится неприятно жестким.
- На стенках посуды заметны солевые отложения.
- На приборах образуется обильная накипь.
- На волосах после мытья и на расческе остается белесый налет.
- Мыло и порошок плохо пенятся, при стирке увеличивается их расход.
Повышенная жесткость питьевой воды может причинить ущерб здоровью и нагревательным приборам. Не зная точных показателей концентрации солей, сложно рассчитать дозу средств от накипи для стирально-сушильных агрегатов или запрограммировать на чистку кофемашину. Трудно обеспечить комфортное обитание рыбкам в аквариуме или правильно выбрать фильтры очистки. Помимо визуальной оценки лучше использовать более точные измерительные методы определения жесткости питьевой и технической воды.
Измерение жесткости воды
Перед употреблением в пищу, перед поливом огорода, перед подачей в трубопроводы или перед техническим применением воды для производственных процессов полезно проверить наличие солей жесткости. Такая проверка снимет претензии потребителей к водоснабжающим компаниям, продлит срок службы дорогого промышленного оборудования.
Для измерения жесткости воды используют бытовые и профессиональные приборы:
- Медицинские полоски, продающиеся в аптеках, выдают хороший результат с точностью до 1-2°Ж.
- Экспресс-тесты для аквариума позволяют следить за подачей воды в емкости с водными обитателями или проверять растворы, предназначенные для полива растений.
- Солемер, спектроанализатор, TDS и EC-метр показывают содержание солей и иные параметры: удельную электропроводность, сопротивление раствора.
Полезно заказать исследование в лаборатории, чтобы получить точные результаты с подтверждающей документацией. Тогда не придется думать, чем определить жесткость воды, не нужно покупать измерительные приборы или рассчитывать показатели по косвенным параметрам, используя формулы.
Как определить жесткость воды по формуле
Определить жесткость воды можно по формуле. Для определения общих показателей нужно выполнить расчет:
Жо = + = (m(Ca2+))/(Э(Ca2+) x V(H2O)) + (m(Mg2+))/(Э(Mg2+) x V(H2O)),
где:
; — концентрация ионов кальция и магния, в мг-экв/дм3;
m(Ca2+); m(Mg2+) — содержание ионов в мг;
V(H2O) — объем воды, дм3;
Э -эквивалентная масса ионов* (её значения уже приводились в тексте: Ca2+=20,04; Mg2+=12,16 мг/лили г/моль).
Расчетный результат получается в единицах: мг-экв/дм3.
Далее вычисляют временную или постоянную жёсткость. Рассчитанную величину вычитают из Жо и получают значения всех трёх категорий Ж.
Карбонатная Жк вычисляется по формуле:
Жк = = (m(HCO3))/(Э(HCO3) х V(H2O))
Некарбонатная: Жнк=Жо-Жк.
Принятые нормативы жесткости
В Российской Федерации есть некоторые расхождения норм с международными стандартами. Разнообразие природных и климатических условий, вариативность используемых для добычи питьевой воды и жидкости для бытового использования не позволяет установить безоговорочно единые нормативы, обязательные для любого региона.
 Пояснение нормативов
Пояснение нормативов
Однако нормы жесткости воды питьевой в целом соответствуют рекомендациям ВОЗ. В неблагополучной экологической обстановке они приводятся в соответствие с санитарно-гигиеническими нормами страны различными способами. Вариантов для этого достаточно много.
На сегодняшний день потребитель может сам контролировать наличие в воде, подаваемой из крана, нормы показателя жесткости и устанавливать различные приспособления для приведения ее в соответствие нормам санитарии и гигиены.
Приведенные ниже нормы касаются временной жесткости, устранение которой возможно и самыми простыми способами. В домашних условиях самый известный – паровой – проводится кипячением воды в чайнике.
Таблица показателей норм кальция и магния по требованиям СанПиН РФ и нормативам ВОЗ.
| Нормативный документ | Продукт | Магний | Кальций | °Ж |
| СанПиН 2.1.4.1074-01; ГН 2.1.5.1315-03 | Питьевая вода | до 50 мг/л | не регламентируется | 7 |
| СанПиН 2.1.4.1116-02 | Бутилированная вода | 5–65 мг/л | 25–130 мг/л | 1,5–7 |
| Рекомендации ВОЗ | Питьевая вода | 10–30 мг/л | 20–80 мг/л | не обозначается |
Измерение в градусах жесткости выглядит следующим образом: менее двух °Ж – это мягкая вода, начиная с двух и до десяти °Ж средней жесткости – нормальный уровень, более 10 – жесткая. Однако в аквариуме нормальным может считаться и показатель в 15 градусов жесткости. Все зависит от того, какие в нем живут обитатели.
Снижение кальция в аквариумной воде происходит за счет потребления необходимых для жизнедеятельности ионов растениями, моллюсками и рыбками. Для понижения уровня временной жесткости могут использоваться разные методы и приспособления.
 Нормативы жесткости
Нормативы жесткости
Воду на питие кипятят. О результативности метода наглядно свидетельствует уровень накипи в чайнике. В бассейне может использоваться мембранный метод фильтрации или магнитогидродинамический резонанс.
Нормы жесткости для питьевой воды
В СанПиН указаны вариативные величины, в зависимости от применения водных растворов. Жесткость воды по ГОСТУ также регламентируется в зависимости от типа и назначения жидкостей:
- Для обычной сетевой водицы определяется концентрация магния (до 50 мг/л).
- В бутилированной учитываются показатели Ca = 25-130 и Mg = 5-65 мг/л.
- Для воды, использующейся в хозяйственно-питьевых целях ПДК питьевой воды по жесткости не должно превышать 350 мг/л (7-10 мг-экв/л или 1-1,5 грамма на литр).
- Для напитков высшей категории нормой является Жо=1,5-7, для первой не более 7 мг-экв/л.
- По ВОЗ-нормативам в питьевой водице допустимо 10-30 мг магния и 20-80 мг кальция на 1 литр.
- Общая жесткость для питьевой воды по EC не выше 1,2 мг-экв/л.
Нормативно установлены нижние пределы показателей жесткости питьевой воды. В нормальной водичке обязательно должно присутствовать небольшое количество солей. Кальций полезен для организма, из напитков его микроэлементы усваивается лучше, чем из продуктов. Массовая концентрация кальция в питьевой воде не должна быть ниже 0,12, магния меньше 0,04, сульфатов и хлоридов менее 2 мг/дм3. Мягкая водичка вымывает из тела кальций, вызывая неприятные последствия — разрушаются кости и зубы. Слишком жесткая вызывает образование камней в организме, нарушает работу системы выделения. Соленая вода разрушительно действует на оборудование гидросистем, засоряет отложениями стенки трубопроводов, увеличивает расходы на нагрев.
Если в воде солей жесткости больше, чем предписано стандартами, нужно её очистить до допустимых показателей. В табличке указаны степени солевой концентрации по шкале жёсткости с показателями в промилле.
Шкала жесткости
| Концентрация солей | Величина в ppm (в промилле или мг/л) |
| Представляющая опасность для жизни | свыше 500 |
| Предельно допустимая | 500 |
| Средний показатель вод, добываемых из природныхводоемов | 400 |
| Допустимое значение воды, подающейся из водопровода | 300 |
| После прохождения угольных фильтров | 170 |
| После очистки системой обратного осмоса | 0-50 |
Методы определения уровня жесткости воды
Для определения общей жесткости Жо:
1. Используется сложное комплексонометрическое титрование трилоном Б . Этот метод самый точный.
Методика: 100 мл воды отбирают в коническую колбу, добавляют 5 мл аммиачно-буферной смеси, затем 7-8 капель спиртового раствора индикатора эриохрома черного Т или щепотку его сухой смеси с хлоридом натрия или калия. После перемешивания раствор окрасится в винно-красный цвет. Его титруют 0,05 н. раствором трилона Б до изменения окраски на сине-зеленую.
2. Покупные экспресс-тесты. Подходят для домашнего использования. Не всегда точные, зато просты в использовании и стоят недорого.
Рисунок 2. Тест-полоски для определения общей жесткости воды.
3. Измерение электропроводности с помощью кондуктометра.
Метод является приблизительным, поскольку электропроводность воды определяет не показатель жесткости, а общее содержание растворенных солей в воде, в том числе солей кальция и магния. Кондуктометр должен измерять именно удельную электропроводность, которая измеряется в мкСм/см, обычный прибор не подойдет.
Рисунок 3. График зависимости удельной электропроводности воды от ее жесткости.
Для определения временной жесткости Жв в химии применяют кислотное титрование соляной кислотой.
При титровании образца воды соляной кислотой в присутствии индикатора метилового оранжевого происходит разложение бикарбонатов, обусловливающих временную жесткость:
Методика определения. В лабораторную коническую колбу отбирают 100 мл исследуемой воды, добавляют 2—3 капли метилового оранжевого и титруют 0,1 н. раствором HCl до появления оранжевой окраски.
После определения общей и временной жесткости, рассчитывают постоянную (некарбонатную) жесткость Жп:
Современные разновидности pH-метров — pH-иономеры позволяют определять временную жесткость на основе титрования соляной кислотой, и общую жесткость с помощью комплексонометрического титрования. Кроме того, они имеют кальций-селективные электроды для различения кальциевой и магниевой жесткости.
Рисунок 4. pH-иономер Metrohm 781.









